Рак молочной железы (РМЖ) занимает лидирующее место в мире среди злокачественных новообразований, диагностируемых у женщин. Разработка биомаркеров, которые могли бы решить проблему прогнозирования прогрессии опухоли, представляет собой одну из наиболее актуальных проблем современной онкологии и лабораторной диагностики. Рост и развитие рака молочной железы сопровождаются увеличением концентрации продуктов перекисного окисления липидов, и содержание продуктов его окисления зависит от степени дифференцировки опухоли. Одним из клинически важных биомаркеров инвазивного прогрессирования опухоли является антиоксидантный фермент марганецсодержащая супероксиддисмутаза [1, 2].
Супероксиддисмутаза (СОД) – один из ключевых антиоксидантных ферментов, которые присутствуют во всех клетках организма человека. В зависимости от металла, содержащегося в активном центре фермента, существует несколько изоформ фермента – цинк-, медь-, марганец-, железо-, никельсодержащие супероксиддисмутазы. В организме человека и млекопитающих встречаются 3 типа супероксиддисмутазы: тип СОД1 (ZnСОД) – он является димером, находится в цитоплазме, содержит цинк как структурный компонент и медь в активном центре; СОД2 (MnСОД) – тетрамерный фермент, находится в митохондриях, содержит марганец Mn(II) или Mn(III) в активном центре; СОД3 (CuСОД) – внеклеточный тетрамерный фермент, в активном центре находится медь.
В организме здорового человека всегда соблюдаются окислительный баланс, динамическое равновесие между уровнем продукции свободных радикалов и активностью антиоксидантной системы защиты, что необходимо для нормального функционирования клетки и обеспечивает ее безопасность в целом [2, 3].
СОД в окислительно-восстановительной реакции защищает клетку от чрезвычайно активного окислителя супероксидного анион-радикала (О2–), катализируя химическую реакцию его диспропорционирования в кислород и пероксид водорода (Н2О2), и таким путем способствует ингибированию воспалительного процесса и окислительной модификации белков [3, 4].
Однако значительное увеличение активности MnСОД приводит к атаке тиоловых и аминогрупп, к избыточной продукции активных форм кислорода, запуску циклической цепной реакции инициации и развитию цепи перекисного окисления липидов (ПОЛ). Повышение его уровня приводит к снижению главных ферментов детоксикации перекиси водорода, каталазы, глутатионпероксидазы, миелопероксидазы, пероксиредоксина и других высокоактивных антиоксидантных систем и вызывает образование высокотоксичных продуктов ПОЛ (альдегидов, кетонов, спиртов), значительное накопление которых приводит к повреждению целостности мембран [5, 6, 7]. Перечисленные ферменты детоксикации перекиси водорода контролируют уровень цитокин-индуцированных пероксидов, участвующих в передаче клеточных сигналов, и истощение их пула приводит к развитию клеточной дисфункции [5]. Так, например, MnСОД в опухолевых клетках превращает супероксид в перекись водорода, которая активирует сигнальный путь ERK1/2, способствуя миграции опухолевых клеток, и тирозинкиназу FAK (киназу фокальной адгезии), чтобы способствовать адгезии опухолевых клеток [6, 7].
Окислительный стресс наблюдается на всех этапах реализации опухолевой генетической программы и вызывает повреждение мембран клеток и митохондрий, липидов, белков, приводит к нарушению водно-ионного гомеостаза, нуклеотидной последовательности дезоксирибонуклеиновых кислот (ДНК), сопровождается вегетативно-медиаторной дисфункцией клетки. Активные формы кислорода нарушают клеточную рецепцию и позволяют опухолевым клеткам уклоняться от распознавания иммунной системой, однако высокий уровень окислительного стресса избирательно оказывает токсическое действие на раковые клетки [5, 8, 9].
Цель исследования: изучить активность ключевого фермента антиоксидантной защиты марганецсодержащей супероксиддисмутазы при раке молочной железы.
Материал и методы исследования
В исследование были включены 60 женщин в возрасте от 35 до 83 лет. Контрольную 1-ю группу составили 15 здоровых женщин. Онкобольные, поступившие на лечение в Республиканский клинический онкологический диспансер (РКОД) г. Уфы с октября 2021 года по ноябрь 2023 года, были разделены на две опытные группы: пациентки с РМЖ 1–2-й стадии (n=21) – 2-я группа, пациентки с РМЖ 3–4-й стадии (n=24) – 3-я группа. Все обследуемые лица дали информированное согласие на проведение исследования.
Для исследования активности MnСОД использовали венозную кровь, полученную утром натощак. После ретракции сгустка пробы центрифугировали при 3000 об/мин в течение 10 минут, затем сыворотку отбирали в микрокюветы. Исследования проводили «сэндвич»-вариантом твердофазного иммуноферментного анализа с применением наборов тест-систем ЗАО «Вектор-Бест» (Новосибирск, Россия).
Для анализа полученных данных использовали стандартный пакет программ Statistica 8.0. Описательная статистика данных представлена в виде медианы и интерквартильного размаха Ме (25–75%). Статистическую значимость различий определяли, используя непараметрические критерии Манна–Уитни, Краскела–Уоллиса и множественное сравнение средних рангов для всех групп. Различия считали значимыми при р<0,05.
Результаты исследования и их обсуждение
Результаты, представленные в таблице 1, свидетельствуют о том, что у пациенток с РМЖ 1–2-й стадии медиана активности MnСОД сопоставима с нижней границей референсных значений показателя, а в сравнении с данными контрольной группы наблюдается тенденция к снижению. У больных с РМЖ 3–4-й стадии активность фермента превышала как верхнюю границу референсных значений, так и показатели контрольной группы (с разницей 54%, р=0,041).
Таблица 1
Активность MnСОД у пациенток с раком молочной железы
|
Референсные значения |
Группы пациенток |
р |
||
|
1-я группа контрольная, n=15 |
2-я группа РМЖ 1–2-й стадии, n=20 |
3-я группа РМЖ 3–4-й стадии, n=24 |
||
|
1190–1990 Ед/л |
1503,1 (1455,9–1567,1) |
1068,3 (1005,8–1358,2) |
2326,8 (886,1–3388,0) |
р1-2=0,139 р1-3=0,895 р2-3=0,041 |
|
Примечание: р1-2, р1-3, р2-3 – статистическая значимость различий между соответствующими группами, критерий Краскела–Уоллиса, множественное сравнение средних рангов для всех групп |
||||
Для более детального анализа данные пациентов с РМЖ 1–2-й и 3–4-й стадий внутри групп были ранжированы по степени активности MnСОД. В каждой группе, таким образом, были выделены по 3 подгруппы: с нормальной, сниженной и повышенной активностью фермента (относительно референсных значений). Показатели сгруппировались следующим образом (рисунок).
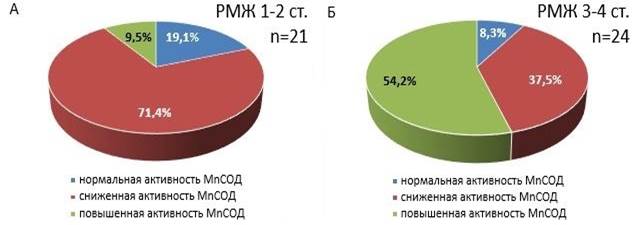
Доля пациентов с РМЖ 1–2-й стадии (А) и 3–4-й стадии (Б) с разной степенью активности фермента MnСОД, в % по отношению к общему числу пациентов в группах
Доля пациентов с активностью MnСОД, соответствующей референсным значениям, была в обеих опытных группах сопоставима друг с другом (рис. А, Б), а медианы активности фермента статистически значимых различий не имели (табл. 2).
Почти у ¾пациентов (71,4%) с 1–2-й стадией заболевания отмечаласьнизкая активность фермента (рис. А), составляющая 86% от нижней границы референсных значений, что имело статистически значимые различия как с подгруппой больных с нормальным уровнем активности MnСОД (р=0,019), так и с повышенным (р=0,022) (табл. 2). Такое снижение, вероятнее всего, связано со снижением емкости этой системы, вызванной напряжением защитных антиоксидантных механизмов. Незначительное повышение активности марганецсодержащей супероксиддисмутазы, отмеченное у небольшой части пациентов с РМЖ 1–2-й степени, по данным литературы, активирует иммунную систему, защищает клетку от повреждения супероксид-анионами за счет уменьшения клеточной пролиферации: MnСОД ингибирует опухолевые клетки, оказывает подавляющее действие на андроген-позитивные клетки рака молочной железы человека [10].
В группе пациентов с РМЖ 3–4-й стадии в 54,2% наблюдений фиксировалась самая высокая активность фермента: медиана показателя достигла 3388,0 (3280,0–3475,6) Ед/л и в 1,7 раза превысила верхнюю границу референсных значений (табл. 2, рис. Б). В этой же группе больных фиксировалась и самая низкая медиана активности MnСОД: 855,4 (855,4–915,9) Ед/л. Доля пациентов с такими показателями была значительна и составила 37,5%. Статистическая значимость различий между группами и подгруппами приведена в таблице 2.
Таблица 2
Степень активности MnСОД в зависимости от стадии рака молочной железы
|
Группа пациенток |
Активность MnСОД, Ед/л |
||
|
1 – нормальная |
2 – пониженная |
3 – повышенная |
|
|
РМЖ 1–2-й стадии, n=21 |
n=4 |
n=15 |
n=2 |
|
1809,2 (1561,5–1854,7) |
1023,7 (879,2–1068,3) |
2270,8 (2181,7–2360,0) |
|
|
|
р1-2=0,019 |
р1-3=1,0 р2-3=0,022 |
|
|
РМЖ 3–4-й стадии, n=24 |
n=2 |
n=9 |
n=13 |
|
1606,4 (1456,3–1756,5) |
855,4 (855,4–915,9) |
3388,0 (3280,0–3475,6) |
|
|
рм-у=0,355 |
рм-у=0,007 р1-2=0,048 |
рм-у=0,027 р1-3=0,040 р2-3<0,001 |
|
|
Примечание: рм-у – статистическая значимость различий между показателями пациентов в опытных группах с РМЖ 1–2-й и РМЖ 3–4-й стадий, критерий Манна–Уитни; р1-2, р1-3, р2-3 – статистическая значимость различий между показателями в подгруппах пациентов с разной степенью активности фермента, критерий Краскела–Уоллиса, множественное сравнение средних рангов для всех групп |
|||
На поздних стадиях РМЖ наблюдается экспрессия активности MnСОД, что может свидетельствовать о наличии метастатического процесса и прогрессировании заболевания. Увеличение фермента антиоксидантной защиты MnСОД указывает на увеличение активных форм кислорода, которые активируют множество сигнальных путей, участвующих в росте новообразований молочной железы [5, 6, 7]. Так, в ходе реакции диспропорционирования супероксида происходит увеличение внутриклеточной концентрации H2O2, что усиливает окислительное повреждение ткани, поскольку в присутствии активаторов (металлов) пероксид водорода мгновенно превращается в гидроксильный радикал (•ОН), обладающий наивысшей реакционной способностью и являющийся самым токсическим и опасным веществом среди всех активных форм кислорода [5]. Повышение активности MnСОД у онкологических больных может быть связано с проводимой интенсивной химиотерапией, сопровождающейся повышением уровня оксида азота, который проявляет цитотоксическое действие, приводящее к различным токсическим эффектам, возникающим как в поздних стадиях заболевания, так и в ходе химиотерапии [11].
Значительное снижение активности фермента MnСОД, наблюдаемое у части больных, указывает на истощение антиоксидантных защитных механизмов и возможное прогрессирование онкозаболевания с развитием метастазов и уменьшением выживаемости больных с раком молочной железы.
Заключение
Выявленные различия в активности фермента MnСОД при раке молочной железы могут быть полезны при установлении стадии опухолевого процесса.
Библиографическая ссылка
Саптарова Л.М., Бикметова Э.Р., Байбурина Д.Э., Имельбаева Э.А., Байбурина Г.А., Тухбатова А.В., Бикметов К.А., Галимов Ш.Н. АКТИВНОСТЬ МАРГАНЕЦСОДЕРЖАЩЕЙ СУПЕРОКСИДДИСМУТАЗЫ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ // Современные проблемы науки и образования. – 2024. – № 2. ;URL: https://science-education.ru/ru/article/view?id=33379 (дата обращения: 01.06.2024).



